随着临床质谱和分子诊断等创新诊断技术的快速发展,其在临床上的应用越来越广泛和深入,监管机构也在与时俱进的逐步更新或出台相关的法规文件或行业标准。为进一步深化医疗器械审评审批制度改革,依据医疗器械产业发展和监管工作实际,按照《医疗器械监督管理条例》《医疗器械分类目录动态调整工作程序》有关要求,国家药监局于3月30日发布公告决定对《医疗器械分类目录》部分内容进行调整,涉及现有分类目录中的27类医疗器械。
对于调整内容的产品,自公告发布之日起,药品监督管理部门依据《医疗器械注册与备案管理办法》《关于公布医疗器械注册申报资料要求和批准证明文件格式的公告》等,按照调整后的类别受理医疗器械注册申请。对于已受理尚未完成注册审批(包括首次注册和延续注册)的医疗器械,药品监督管理部门继续按照原受理类别审评审批,准予注册的,核发医疗器械注册证,并在注册证备注栏注明调整后的产品管理类别。
对于已注册的医疗器械,其管理类别由第三类调整为第二类的,医疗器械注册证在有效期内继续有效。如需延续的,注册人应当在医疗器械注册证有效期届满6个月前,按照改变后的类别向相应药品监督管理部门申请延续注册,准予延续注册的,按照调整后的产品管理类别核发医疗器械注册证。医疗器械注册证有效期内发生注册变更的,注册人应当向原注册部门申请变更注册。如原注册证为按照原《医疗器械分类目录》核发,本公告涉及产品的变更注册文件备注栏中应当注明公告实施后的产品管理类别。
其中,通知明确对生化分析仪器、免疫印迹仪器、生化免疫分析仪器、核酸扩增分析仪器、微生物质谱鉴定仪器、图像扫描仪器、质谱检测系统、液相色谱分析仪器部分内容进行调整。
质谱相关器械
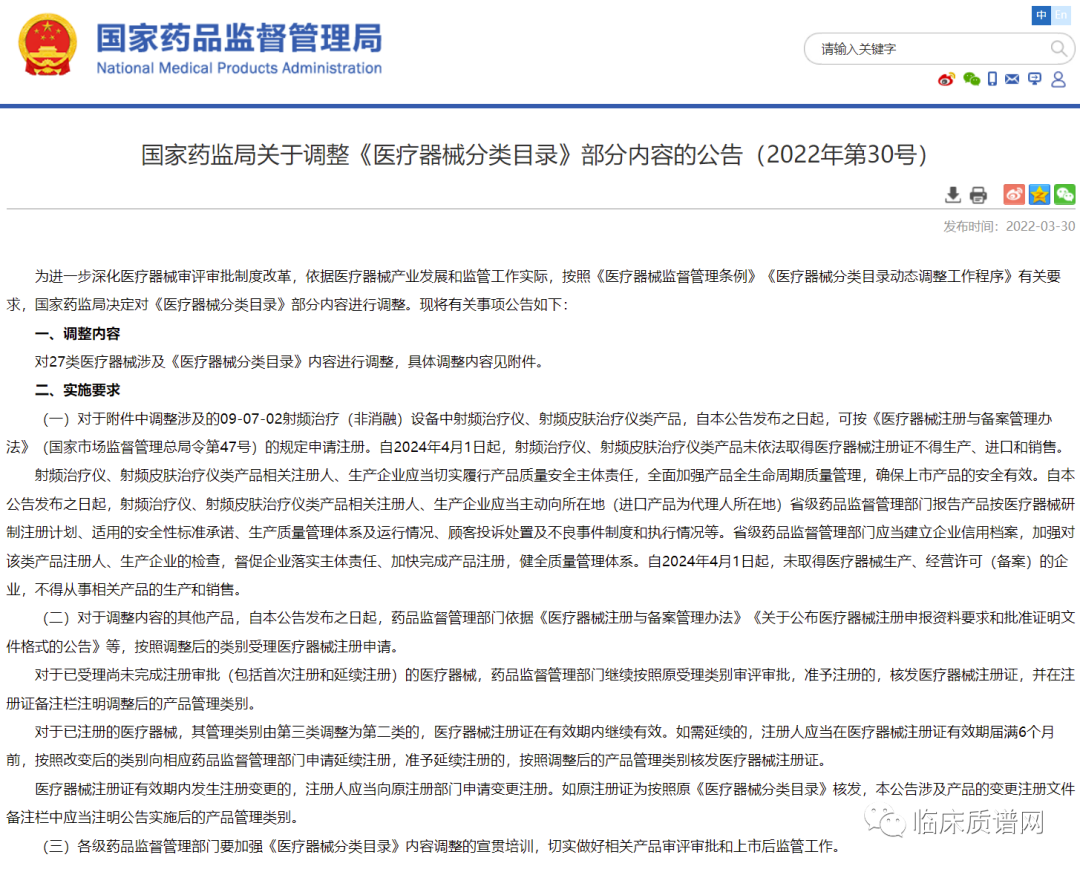
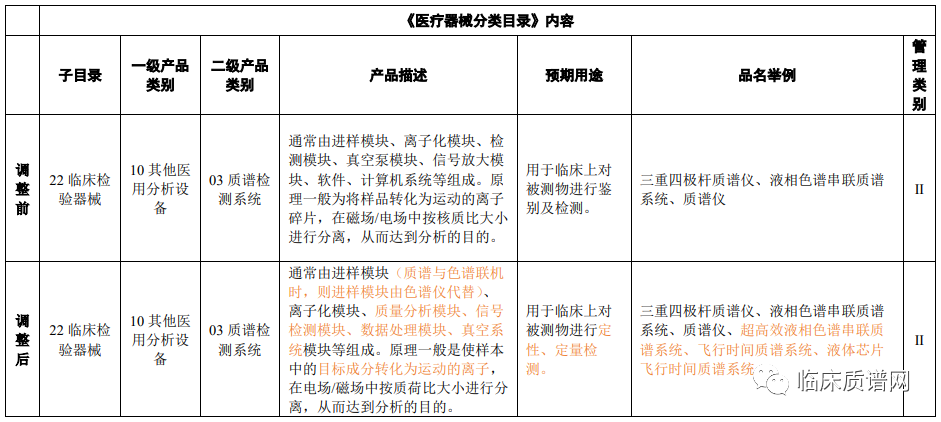
对于质谱检测系统,产品类别和管理类别均未变化(管理类别均为II类医疗器械),但对产品的组成模块和原理以及预期用途进行了更加详细和准确的表述。同时在品名举例中增加了超高效液相色谱串联质谱系统、飞行时间质谱系统、液体芯片飞行时间质谱系统。关于微生物质谱鉴定仪器,则主要对其产品描述进行了补充,增加了数据库,并对鉴定的过程原理进行了描述。此次调整丰富了临床质谱检测系统的仪器类别,同时也更加明确了质谱的用途和检测优势。
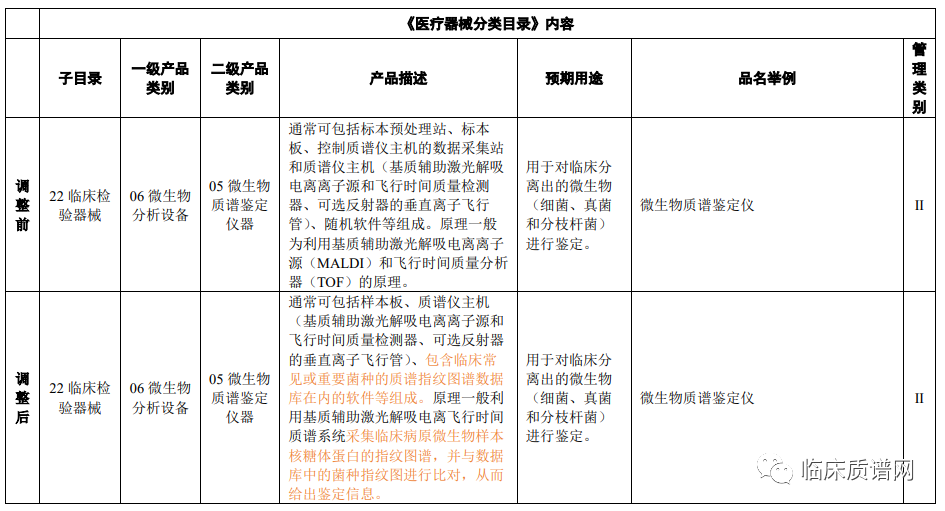
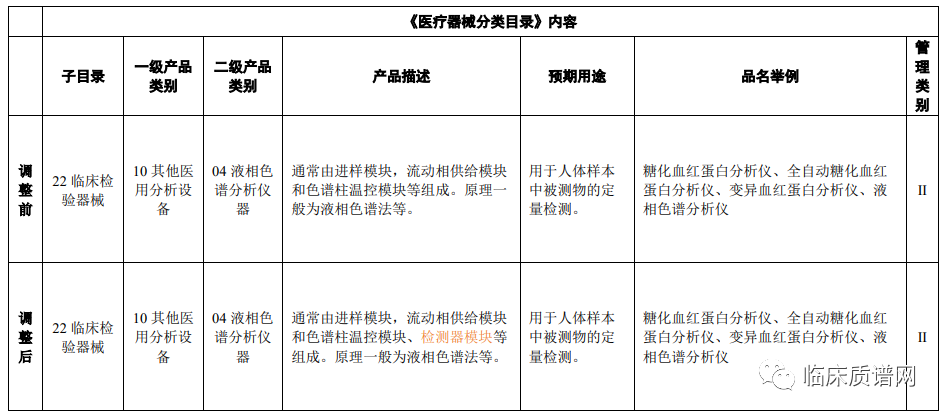
关于液相色谱分析仪器,仅在产品描述中将检测器模块加入了仪器组成部分。
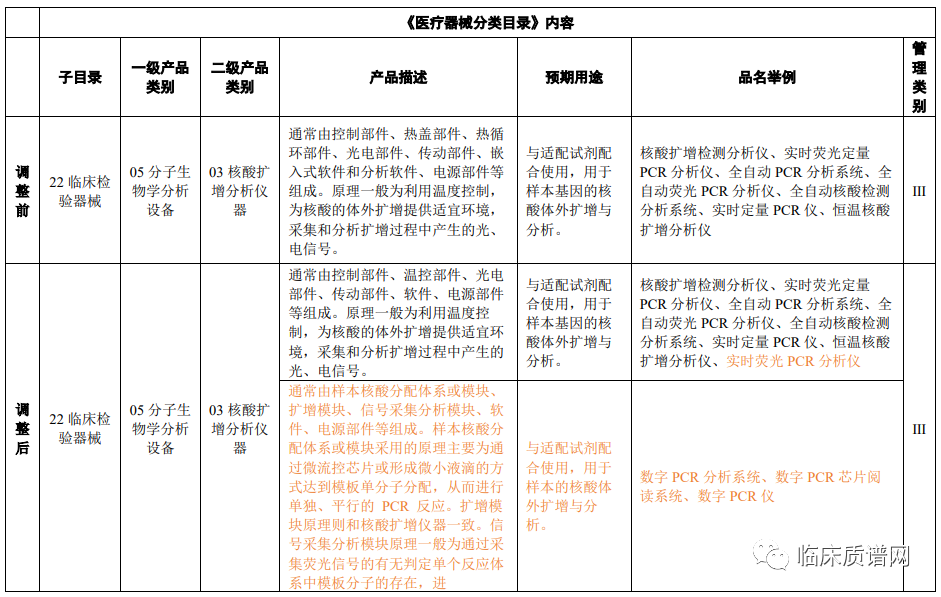
分子诊断相关器械
核酸扩增分析仪器的产品类别属于临床检验器械-分子生物学分析设备,管理类别属于Ⅲ类医疗器械,两者均未变化,但是增加了数字PCR相关的产品描述和预期用途的介绍(近年来迅速发展起来的一种绝对定量的PCR技术)。
无论是质谱仪器还是分子检测仪器,新的创新诊断技术的涌现很好地满足了临床的需求,最终将造福于人类。《医疗器械分类目录》内容的补充和完善也将进一步增加相关技术在临床检验中的推广和普及应用,同时医疗器械厂家对不同产品品类申请注册医疗器械证时也会变得更加有据可循,有法可依。














