摘要:目的 分析2015—2019年上海地区25-羟基维生素D[25(OH)D)项目室间质量评价(EQA)结果,为提高25(OH)D检测质量提供依据。方法 收集2015—2019年上海市临床检验中心(SCCL)25(OH)D项目的10次EQA结果,剔除离群值后计算各组均值(x)、标准差(s)和变异系数(CV)。
结果 参加SCCL 25(OH)D项目EQA的实验室数从2015年的41家增加至2019年的83家,5年内10次EQA的合格率分别为65.85%、74.70%、82.00%、83.67%、90.91%、87.50%、86.67%、91.89%、92.68%、92.77%。参评实验室的检测方法主要为电化学发光法和化学发光法,少数实验室使用酶联免疫吸附试验和液相色谱串联质谱法。在5年50个批号的EQA样本中,33个批次检测CV<20%,6个批次检测CV为20%~30%,其他批次检测CV均>30%。
结论 上海地区不同实验室25(OH)D检测结果仍存在较大差异,应加强实验室检测质量管理,推动25(OH)D检测的标准化,促进实验室间的结果互认。
维生素D是一类脂溶性类固醇激素,通过调节肠钙吸收和肾脏重吸收维持钙平衡。随着人口老龄化和疾病谱的改变,维生素D作为维持生命活动所必需的一类有机物质,其主要作用已经从传统应用范畴扩展到心血管疾病、自身免疫性疾病、糖尿病、肿瘤等各类疾病的治疗中[1,2,3],具有减轻胰岛素抵抗、调节免疫、移植细胞增殖、促进细胞分化、抗炎性反应及抗纤维化等非骨骼系统作用[4,5,6]。生理状态下,人体血液中维生素D的主要形式是25-羟基维生素D[25-hydroxyvitamin D,25(OH)D],是评价维生素D营养状态的最佳指标。
随着维生素D的功能被不断深入地认识,临床对25(OH)D的检测需求也日益增加,检测质量日益受到重视,商品化25(OH)D检测试剂盒种类也越来越多。常用的25(OH)D检测试剂盒的检测原理包括全自动化学发光法、电化学发光法、酶联免疫吸附试验,还有一些实验室自建的液相色谱串联质谱法。有研究发现,不同方法检测25(OH)D的结果差异显著[7]。检测结果不同将直接影响到临床医生对患者体内维生素D水平的判断[8],因此如何做好25(OH)D的检测质量控制,成为质量保证的重点。
室间质量评价(external quality assessment,EQA)是由实验室外部的某个独立机构按照预先制定的准则,利用实验室间的结果对参评实验室进行检测能力评价的活动[9]。上海市临床检验中心(Shanghai Center for Clinical Laboratory,SCCL)是获得中国合格评定国家认可委员会认可的临床检验质量控制组织评价机构。SCCL每年按计划向各实验室发放未知样本,对检验人员的技术水平进行考核,并对检测结果进行评价,2015年开始开展25(OH)D项目的EQA活动。本研究主要针对上海地区医学实验室2015—2019年EQA 25(OH)D检测结果进行分析,以了解上海地区25(OH)D的检测质量,为该项目的标准化提供参考。
1 材料和方法
1.1 EQA样品准备
2015—2019年25(OH)D EQA样品均为商品化质控品,其中2015、2016年EQA样品购自英国朗道公司,2017、2018、2019年EQA样品购自美国伯乐公司。该项目所有质控品均为经处理的人源血清制备的血清样品。所有样品发放前均按照能力验证提供者认可准则(CNAS-CL03:2010)[10]要求进行均匀性和稳定性评价,确保每个参评实验室都收到具有可比性的能力验证样品,并且在整个能力验证过程中保持稳定。所有EQA质控品均在2~8 ℃条件下运输和保存。
1.2 方法
1.2.1 EQA方案设计 25(OH)D 项目的EQA计划设计在内分泌组,各质控品由SCCL统一时间发放,每年2次,每次发放5水平样品。各实验室按说明书要求复溶后,按日常患者检测样本处理方式处理,由日常工作人员使用实验室常规检测系统(仪器、试剂和方法等)检测,检测次数应与常规检测患者样本的次数相同。检测结束后按照要求上报结果。
1.2.2 结果评价与分析 根据SCCL能力验证项目统计方案对上报数据进行统计处理。EQA统计分析以参加者的公议值为指定值。上报数据根据检测仪器进行分组,分别为瑞士罗氏公司(简称罗氏)、意大利索灵公司(简称索灵)、深圳新产业公司(简称新产业)、深圳迈瑞公司(简称迈瑞)、德国西门子公司(简称西门子)、美国雅培公司(简称雅培),剔除粗大误差后进行统计学分析。上报数据中明显的错误结果(单位换算、小数点、计算等粗大误差)由专家识别,并且计算合计统计量时剔除该值,但这些结果仍在能力验证计划中予以评价。25(OH)D项目的能力评定标准为靶值±25%,参评实验室某一样品检测结果在能力评定标准范围内,则该样品检测结果为满意。1次能力验证活动参评实验室单个项目的5个样品检测结果至少80%达到满意,则该项目为合格,某一项目的得分计算公式为:该项目的可接受结果数/该项目总测定样品数×100。本研究其他数据分析采用SPSS 20.0统计软件完成,对不同分组样本进行Mann-Whitney Wilcoxon检验和Kruskal-Wallis检验,不同年度单项目合格率进行Pearson χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 实验室回报情况
参加SCCL EQA活动的实验室包括上海地区开展该项目的各级各类医疗卫生机构检验科、临床实验室、医学实验室以及仪器、试剂生产企业实验室和独立实验室。2019年共83家参评实验室上报25(OH)D检测结果,除1家采用酶联免疫吸附试验外,其他82家均为化学发光发和电化学发光法;有85.54%的实验室使用进口检测系统检测25(OH)D。见表1。
表1 2019年上海地区医疗机构检测实验25(OH)D项目开展情况
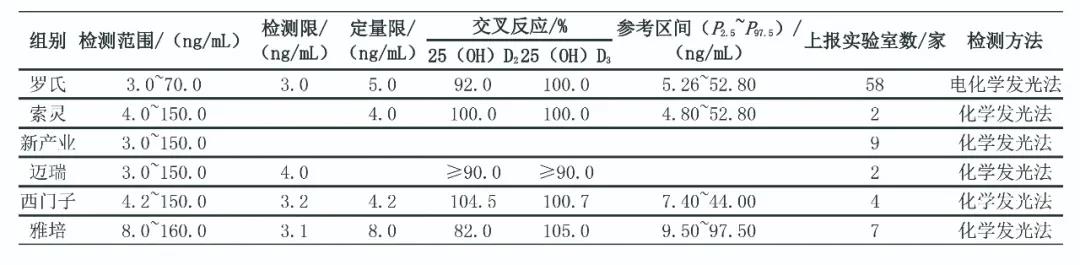
注:表中空白表示无此项。
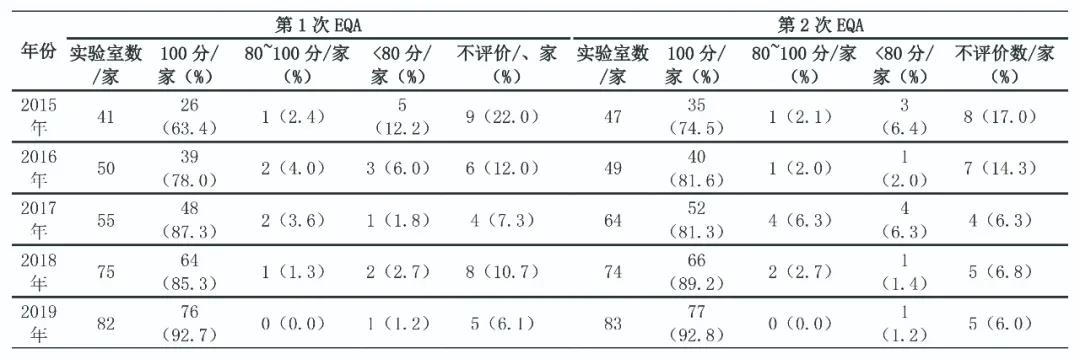
SCCL 2015—2019年开展10次25(OH)D EQA活动,发放不同浓度水平样品50份。参评实验室从2015年第1次的41家逐年增加到2019年第2次的83家,增加了102.4%。参评实验室的检测方法包括化学发光法、电化学发光法、酶联免疫吸附试验、荧光免疫法、液相色谱串联质谱及其他方法。2015年第1次EQA 27家合格、5家不合格、9家不评价,单项合格率为65.8%(27/41);2019年第2次EQA 77家合格、1家不合格、5家不评价,单项目合格率为92.8%(77/83)。见表2。
表2 2015-2019年上海地区25(OH)D EQA合格率
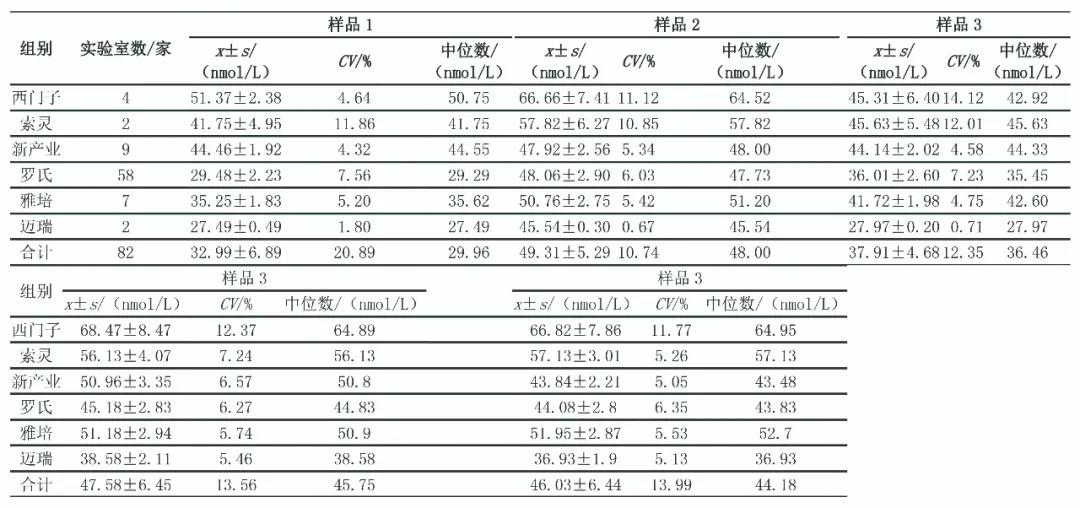
根据2015—2019年25(OH)D EQA上报数据剔除粗大误差后总体均值(x)、标准差(s)和变异系数(coefficient of variation,CV)等统计量(表3),对不同检测批次的EQA CV作Wilcoxon符号秩和检验和Kruskal-Wallis检验,不同年度25(OH)D检测结果CV差异有统计学意义(P<0.000 1)。2019年EQA数据按照检测方法分为化学发光法、电化学发光法、酶联免疫吸附试验3个组,除1921、1922 2个批次外,其他批次样品不同方法检测结果差异均有统计学意义(P<0.05)。2019年不同仪器组EQA数据统计结果见表4、表5。
表3 2015—2019年25(OH)D EQA数据(剔除后)
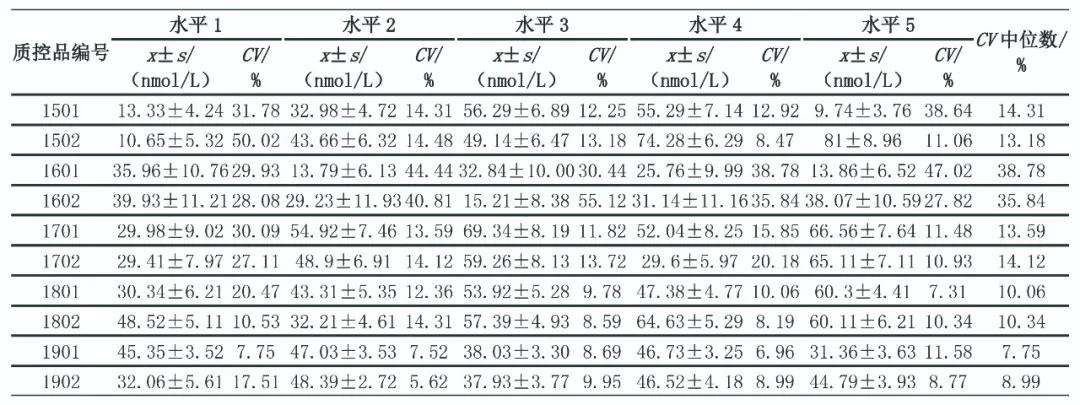
表4 2019年25(OH)D项目第1次EQA数据(剔除前)
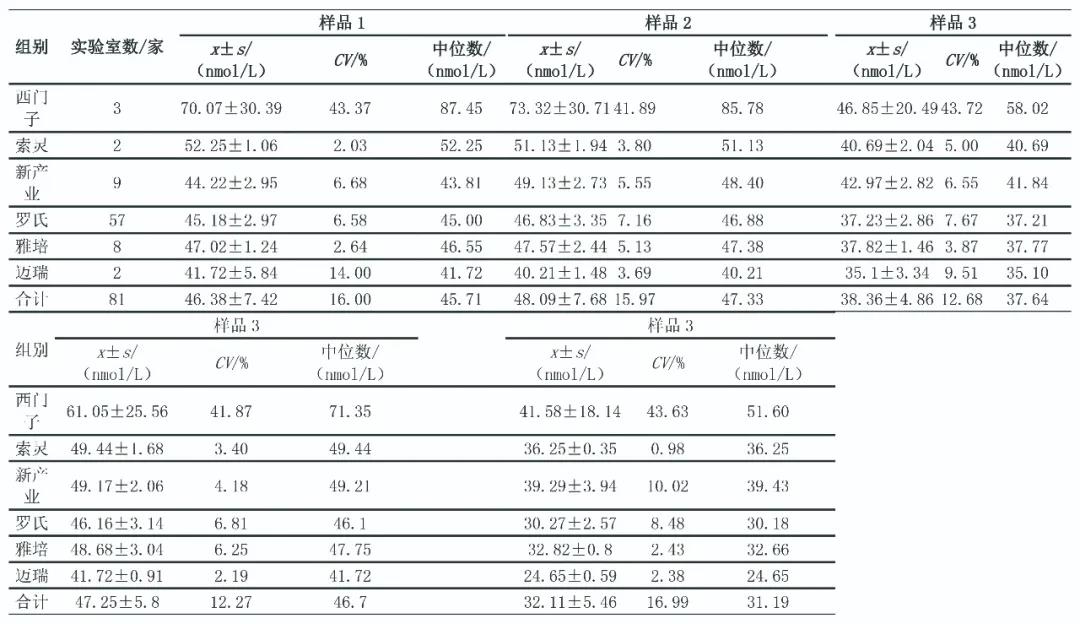
表5 2019年25(OH)D项目第2次EQA数据(剔除前)
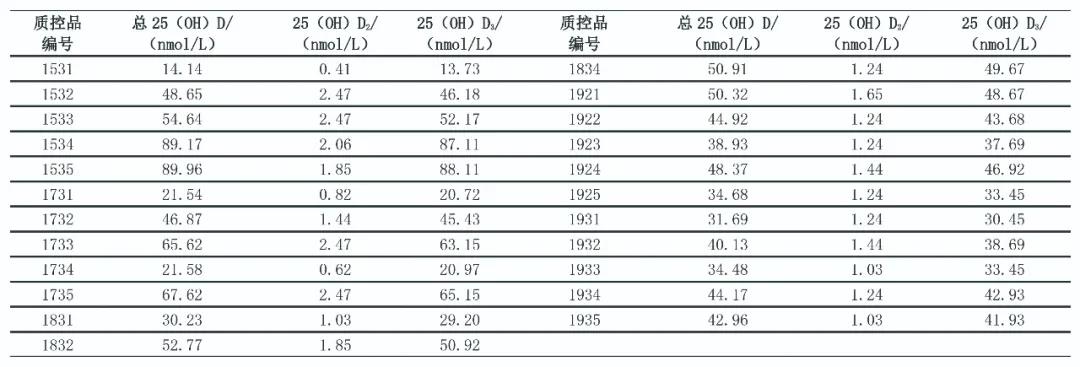
2015—2019年,23个批次EQA质控品用液相色谱串联质谱法进行检测,检测结果见表6。
表6 2015-2019年23个批次EQA质控品的质谱检测数据
以液相色谱串联质谱法检测值作为参考值,对应批次的EQA上报数据根据检测仪器进行分组,比较组内均值和参考值,计算偏移,计算公式为:偏移=(组内均值-参考值)/参考值,实验室数<2时直接使用原始数据进行比较。各仪器组(实验室数>2家)与液相色谱串联质谱法检测结果的差异见图1。
图1 各仪器组均值与液相色谱串联质谱结果的偏移
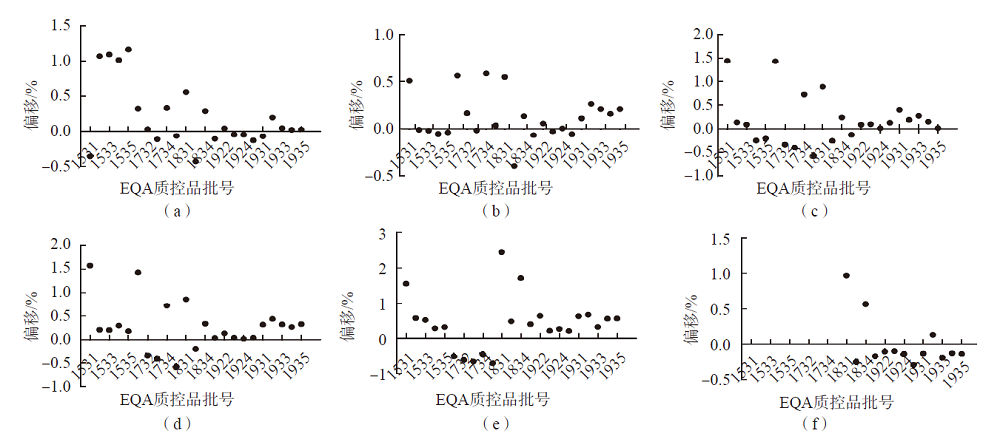
注:(a)~(f)分别为罗氏、雅培、新产业、索灵、西门子-迈瑞系统。
3 讨论
我国人群维生素D缺乏的情况广泛存在[11]。随着临床对25(OH)D检测需求的增多,检测实验室对25(OH)D的检测质量也受到广泛关注[12]。2010年,美国国立卫生研究院、美国疾病预防控制中心、美国国家标准和技术研究院和比利时根特大学合作,开始维生素D标准化计划,以期解决维生素D检测面临的问题。美国病理学家协会组织的维生素D正确度验证计划数据显示,能力验证计划对实验室维生素D检测能力的提升起到了良好的促进作用[13]。SCCL也于2018年开始开展基于液相色谱串联质谱法的EQA和正确度验证计划。本研究结果显示,上海地区医学检测实验室25(OH)D 项目的EQA合格率从2015年的65.8%上升到2019年的92.8%,单项合格率显著提高。从每年EQA数据的CV中位数看,上海地区医学检测实验室对25(OH)D的检测离散程度逐渐变小,提示各实验室间检测能力一致性有所提高。对不合格的结果进行分析,推测不合格原因主要有以下几个方面:(1)质控品运输和保存时,出现严重偏离正常保存条件的情况,导致质控品变质;(2)实验室人员未严格按说明书要求进行样品复溶;(3)上报错误,如未进行单位换算或质控品编号混淆及填写错误;(4)仪器/方法的性能变化,如仪器故障等。实验室应加强人员培训及仪器维护,以提高检测质量。
尽管25(OH)D项目EQA合格率在逐年提高,但不同检测方法与检测系统间的差异依旧存在。2019年10批次EQA样品检测数据间差异显著(表4、表5),与之前的血清样品的EQA结果一致[14]。结合厂家声称的试剂性能与检测参考区间(表1)对结果进行分析,推测造成这一现象的原因除了不同系统本身存在的差异之外,还可能与本研究所选用的检测样品类型有关。本研究中所有样品均为经处理的人源血清制备的血清样品,厂家在制备过程中基于稳定性或冻干成形的要求可能添加了非血清来源的物质,从而使样品基质发生改变。这些添加剂产生的基质效应可能导致了不同检测系统间检测结果的差异。本研究结果显示,化学发光法的CV显著高于电化学发光法的CV,除了方法学差异的影响外,还有可能是因为化学发光法组里包含了不同的仪器组,而电化学发光法只有罗氏组。化学发光法组中,尽管采用的方法相同,不同品牌抗体识别抗原表位的差异可能会导致检测系统对25(OH)D的检测能力出现差异,血液中其他维生素D代谢物或类似物的干扰也会导致检测结果的差异。近年来,液相色谱串联质谱法因可对目标化合物直接定量而逐渐成为“金标准”的检测方法。本研究不同检测系统检测结果与液相色谱串联质谱法的差异依旧存在,但随着EQA的开展,部分检测系统与液相色谱串联质谱法的差异逐渐减小,检测性能有所提升。本研究中液相色谱串联质谱法、电化学发光法和荧光免疫法3种方法因使用的实验室太少,其在EQA中的表现需要更多数据进行验证。
本研究也存在一定的缺陷:一是本研究是对历年EQA数据的回顾性分析,质控物检测结果的差异并不能等同于常规检测样本的结果差异;二是质控物浓度不能完全覆盖医学决定水平,如2019年缺乏25(OH)D<30 ng/mL的质控品,因此无法准确评价各检测实验室对低浓度25(OH)D的检测能力。
随着临床对维生素D的应用的拓展,维生素D检测的质量也越来越受重视。EQA作为一项质量保证活动,也是内部质量控制的有效补充,其结果也逐渐成为各国际组织、认可机构和政府管理部门对实验室检测能力进行监督评价的依据。我们希望通过EQA活动,发现实验室检测中存在的问题,并加以改进,以提高各医学实验室的25(OH)D检测水平,逐步提高常规检测的准确性和可比性,为检测结果互认提供保证。
参考文献
[1]SCRAGG R,STEWART A W,WAAYER D,et al.Effect of monthly high-dose vitamin D supplementation on cardiovascular disease in the vitamin D assessment study:a randomized clinical trial [J]. JAMA Cardiol,2017,2(6):608-616.
[2]LEE Y H,BAE SC. Vitamin D level in rheumatoid arthritis and its correlation with the disease activity:a meta-analysis [J]. Clin Exp Rheumatol,2016,34(5):827-833.
[3]MONDUL A M,WEINSTEIN S J,LAYNE T M,et al.Vitamin D and cancer risk and mortality:state of the science,gaps,and challenges [J]. Epidemiol Rev,2017,39(1):28-48.
[4]ZHAO G,FORD E S,LI C. Associations of serum concentrations of 25-hydroxyvitamin D and parathyroid hormone with surrogate markers of insulin resistance among U.S. adults without physician-diagnosed diabetes:NHANES,2003-2006 [J]. Diabetes Care,2010,33(2):344-347.
[5]ARTAZA J N,NORRIS K C. Vitamin D reduces the expression of collagen and key profibrotic factors by inducing an antifibrotic phenotype in mesenchymal multipotent cells [J]. J Endocrinol,2009,200(2):207-221.
[6]KAMEN D L,TANGPRICHA V. Vitamin D and molecular actions on the immune system:modulation of innate and autoimmunity [J]. J Mol Med(Berl),2010,88(5):441-450.
[7]SEMPOS C T,HEIJBOER A C,BIKLE D D,et al. Vitamin D assays and the definition of hypovitaminosis D:results from the first international conference on controversies in vitamin D[J]. Br J Clin Pharmacol,2018,84(10):2194-2207.
[8]BINKLEY N,CARTER G D.Toward clarity in clinical vitamin D status assessment:25(OH)D assay standardization [J]. Endocrinol Metab Clin North Am,2017,46(4):885-899.
[9]中华人民共和国国家卫生健康委员会. 临床检验室间质量评价 [S]. WS/T644-2018,中华人民共和国卫生部,2018.
[10]International Organization for Standardization. Accreditation criteria for proficiency testing providers [S]. ISO/IEC17043,ISO,2010.
[11]VAN SCHOOR N,LIPS P.Global overview of vitamin D status [J]. Endocrinol Metab Clin North Am,2017,46(4):845-870.
[12]CARTER G D. Accuracy of 25-hydroxyvitamin D assays:Confronting the issues [J]. Curr Drug Targets,2011,12(1):19-28.
[13]ERDMAN P,PALMER-TOY D E,HOROWITZ G,et al.Accuracy-based vitamin D survey:six years of quality improvement guided by proficiency testing [J]. Arch Pathol Lab Med,2019,143(12):1531-1538.
[14]禹松林,方慧玲,程歆琦,等. 五种自动化免疫学方法和液相色谱串联质谱方法测定25羟基维生素D的比较[J]. 中华检验医学杂志,2015,38(7):475-479.
来源: 检验医学, 2021, 36(2): 219-224
















